Calcolatore di Impatto Dietetico sul Microbioma Intestinale
Valuta il tuo impatto sulla salute del microbioma intestinale in relazione all'artrite reumatoide. Rispondi alle domande per ricevere consigli personalizzati.
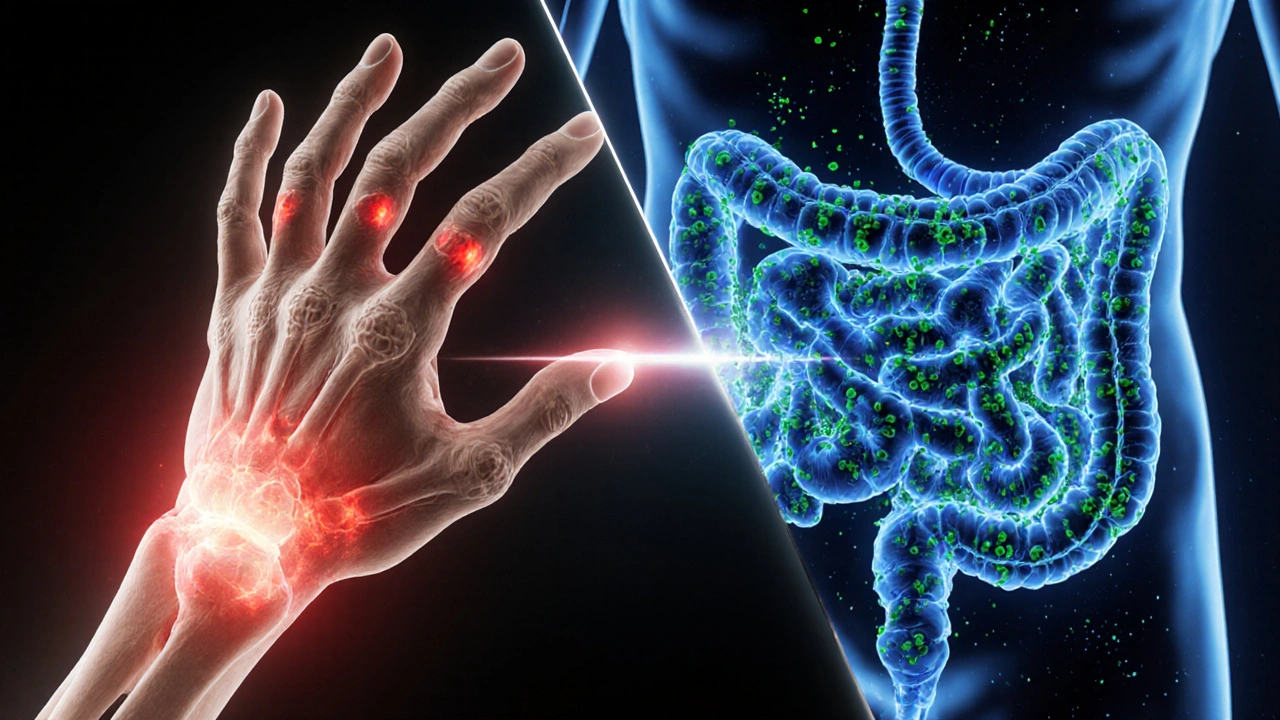
Quando si sente parlare di artrite reumatoide è una malattia autoimmune cronica che colpisce le articolazioni, provocando dolore, gonfiore e, a lungo andare, danni irreversibili, è facile immaginare solo le articolazioni in lotta. Però la ricerca degli ultimi anni mostra che l’microbioma intestinale l’insieme dei trilioni di microrganismi che vivono nel nostro tratto digestivo gioca un ruolo chiave nel modulare l’infiammazione sistemica che alimenta l’artrite. Scopriamo insieme come queste due realtà si influenzano a vicenda e quali azioni concrete puoi intraprendere.
Punti chiave
- L’infiammazione dell’artrite reumatoide è in parte scatenata da squilibri del microbioma intestinale (disbiosi).
- Specifici gruppi batterici, come Prevotella copri, sono stati collegati a forme più aggressive della malattia.
- Diete ricche di fibre, alimenti fermentati e probiotici possono favorire un microbioma più “amico” delle articolazioni.
- Gli antibiotici, se usati senza criteri, possono aggravare la disbiosi e peggiorare i sintomi.
- Le terapie biologiche stanno iniziando a includere la modulazione del microbioma come co‑strategia.
Cos’è l’artrite reumatoide
L’artrite reumatoide (AR) è caratterizzata da un’attività autoimmune che colpisce soprattutto le piccole articolazioni delle mani e dei piedi. Il sistema immunitario, anziché difendere, attacca il tessuto sinoviale, provocando proliferazione della membrana articolare, formazione di pannus e, infine, erosioni ossee. I fattori genetici - ad esempio il gene HLA‑DRB1 - aumentano la predisposizione, ma l’ambiente è altrettanto decisivo.
Cos’è il microbioma intestinale
Il microbioma intestinale comprende batteri, archaea, virus e funghi che co‑esistono in un delicato equilibrio. Tra le sue funzioni ci sono la digestione delle fibre, la produzione di acidi grassi a catena corta (SCFA) e la modulazione del sistema immunitario. Quando questo ecosistema si squilibra - condizione nota come disbiosi - si verificano alterazioni nella permeabilità intestinale (leaky gut) e nella risposta infiammatoria.
Meccanismi di interazione tra AR e microbioma
Le ricerche indicano tre percorsi principali:
- Leaky gut: una barriera intestinale compromessa permette il transito di lipopolisaccaridi (LPS) e altre molecole pro‑infiammatorie nel sangue, attivando i macrofagi e le cellule T.
- Modulazione delle cellule T: alcuni batteri, come Bifidobacterium e Lactobacillus, stimolano le cellule T regolatorie (Treg) che dampano l’auto‑immune. Altri, come Prevotella copri, aumentano le cellule Th17, note per promuovere l’infiammazione articolare.
- Produzione di metaboliti: gli SCFA (butirrato, acetato, propionato) hanno effetti anti‑infiammatori sul tessuto sinoviale. Una carenza di questi metaboliti è stata osservata in pazienti con AR.

Le evidenze cliniche più recenti
Uno studio dell’Università di Utrecht (2023) ha confrontato il microbioma di 120 pazienti AR con 80 controlli sani. I risultati mostrano un aumento del 30% di Prevotella copri nei pazienti con attività di malattia alta, mentre i soggetti in remissione presentavano una maggiore abbondanza di Faecalibacterium prausnitzii, noto per le sue proprietà anti‑infiammatorie.
Un trial randomizzato (2024) ha somministrato una miscela di probiotici (Lactobacillus casei, Bifidobacterium longum) a 60 pazienti AR per 12 settimane. I partecipanti hanno registrato una riduzione media del punteggio DAS28 del 1,2 punti, accompagnata da un aumento dei livelli plasmatici di butirrato.
Alcune ricerche hanno anche evidenziato che i pazienti sotto terapia biologica anti‑TNF mostrano un riequilibrio del microbioma più rapido rispetto a chi assume DMARD tradizionali, suggerendo un’interazione terapeutica bidirezionale.
Strategie per influenzare il microbioma
Se desideri migliorare la tua condizione, puoi intervenire su più fronti:
- Dieta ricca di fibre: frutta, verdura, legumi e cereali integrali forniscono substrati per la produzione di SCFA. Una dieta mediterranea tipica (olio d’oliva, pesce, noci) è associata a un microbioma più diversificato.
- Alimenti fermentati: kefir, yogurt, crauti e miso introducono batteri benefici e aumentano la resilienza intestinale.
- Probiotici mirati: scegli integratori contenenti Lactobacillus e Bifidobacterium a dose clinicamente studiata (≈10⁹‑10¹⁰ CFU/giorno).
- Prebiotici: inulina, frutto-oligosaccaridi (FOS) favoriscono la crescita di batteri anti‑infiammatori.
- Uso prudente degli antibiotici: limitare le cure antibiotiche a situazioni strettamente necessarie riduce il rischio di disbiosi.
- Evitare eccessi di zuccheri e grassi saturi: questi alimenti favoriscono Enterobacteriaceae, legate a stati pro‑infiammatori.
Tabella riassuntiva dei principali gruppi batterici
| Gruppo batterico | Effetto sul decorso AR | Strategia di modulazione |
|---|---|---|
| Prevotella copri | Incrementa attività infiammatoria | Ridurre zuccheri raffinati, aumentare fibre solubili |
| Faecalibacterium prausnitzii | Effetto anti‑infiammatorio, produzione di butirrato | Assumere prebiotici (inulina), probiotici di tipo Lactobacillus |
| Bifidobacterium longum | Potenzia cellule Treg | Supplementi probiotici, yogurt con vivo‑cultures |
| Enterobacteriaceae | Associato a risposta pro‑infiammatoria | Limitare cibi ultra‑processati, aumentare antiossidanti |

Consigli pratici per i pazienti con AR
1. Fai un diario alimentare per almeno due settimane. Annotare cosa mangi e come ti senti ti aiuterà a capire quali alimenti sembrano scatenare i sintomi.
2. Integra una porzione di alimenti fermentati al giorno. Se non ti piacciono i crauti, prova un bicchiere di kefir o uno yogurt greco senza zuccheri aggiunti.
3. Assumi un probiotico a spettro ampio, preferibilmente con Lactobacillus rhamnosus GG e Bifidobacterium breve, per almeno tre mesi, monitorando eventuali miglioramenti nel DAS28.
4. Parla con il tuo reumatologo prima di modificare la terapia antibiotica o introdurre nuovi supplementi, soprattutto se sei in trattamento con farmaci biologici.
5. Fai attività fisica moderata, come camminata veloce o yoga, che aiuta la motilità intestinale e riduce lo stress, entrambi fattori che influenzano il microbioma.
Prospettive future
Gli scienziati stanno esplorando l’uso di “fecal microbiota transplantation” (FMT) per AR. I primi trial di fase I (2025) mostrano una diminuzione temporanea dei marker infiammatori in alcuni pazienti, ma la sicurezza a lungo termine resta da confermare. Inoltre, la genomica metagenomica sta permettendo di identificare ceppi batterici personalizzati che potrebbero essere somministrati come terapia di precisione.
In sintesi, l’interazione tra artrite reumatoide e microbioma intestinale è ormai una realtà clinica. Modificando la dieta, scegliendo probiotici adatti e gestendo con attenzione gli antibiotici, puoi ridurre l’infiammazione e migliorare la qualità della vita, supportando al contempo le terapie tradizionali.
Domande frequenti
Il microbioma può causare l’artrite reumatoide?
Il microbioma non è l’unica causa, ma gli squilibri (disbiosi) possono scatenare o aggravare l’infiammazione articolare attraverso meccanismi come il leaky gut e la modulazione delle cellule T.
Quali alimenti devo assolutamente evitare?
È consigliabile limitare zuccheri raffinati, bevande gassate, cibi ultra‑processati e grassi saturi, poiché favoriscono la crescita di batteri pro‑infiammatori.
I probiotici sono sicuri se prendo farmaci biologici?
In generale sì, ma la scelta del ceppo e la dose devono essere discussi con il reumatologo per evitare interazioni o infezioni opportunistiche.
Quanto tempo occorre per vedere effetti positivi dalla dieta?
Molti pazienti riportano miglioramenti entro 4‑6 settimane, ma la stabilizzazione del microbioma può richiedere 3‑6 mesi di impegno costante.
La terapia FMT è disponibile per tutti?
Al momento è limitata a studi clinici controllati; non è una pratica di routine e deve essere eseguita in centri specializzati.





Leonardo Guedes L. Martins
ottobre 15, 2025 AT 13:39Nel vasto panorama della ricerca immunologica, l’intersezione tra artrite reumatoide e microbioma si erge a fulgido esempio di complessità ecosistemica. Ciò che una volta si limitava a descrivere la sinovite come mera infiammazione articolare è ora avvolto da una rete di interazioni microbiche che echeggiano ben oltre la giunzione muscolo‑tendinea. Le evidenze emergenti rivelano che la _Prevotella copri_, quasi un archetipo di patogenesi, prospera in un ambiente ricco di zuccheri semplici, infliggendosi come una sinfonia dissonante al sistema immunitario. Parallelamente, specie benefiche quali _Faecalibacterium prausnitzii_ operano come silenziosi custodi della tolleranza immunologica, irrigando la mucosa con butirrato, l’acido grasso a catena corta dal potere anti‑infiammatorio quasi magico. Il concetto di ‘leaky gut’ non è più relegato al folklore gastroenterologico, ma costituisce un canale di traffico per lipopolisaccaridi (LPS) che, una volta nel circolo sanguigno, accendono i macrofagi con la vigoria di un fuoco d’artificio. Questo fenomeno si traduce, nella pratica clinica, in un punteggio DAS28 più elevato, e spinge i reumatologi a guardare oltre le DMARD e a contemplare l’ecosistema intestinale. Le diete ricche di fibre, che alimentano la fermentazione e la produzione di SCFA, si configurano quindi non solo come consigli nutrizionali, ma come armi strategiche contro l’autodistruzione sinoviale. Il consumo regolare di kefir, miso e crauti, arricchito da prebiotici quali l’inulina, può indurre una transizione dalla dominanza di Enterobacteriaceae verso una flora più ortogonalmente equilibrata. Studi randomizzati condotti nel 2024 hanno dimostrato che un regime probiotico mirato riduce mediamente il DAS28 di 1,2 punti, confermando l’efficacia clinica di un approccio multitarget. Allo stesso tempo, le terapie biomediche anti‑TNF sembrano favorire un riequilibrio microbico più rapido, suggerendo una sinergia bidirezionale che promette di rivoluzionare la gestione personalizzata dei pazienti. Non vanno dimenticati gli aspetti di farmacovigilanza: l’abuso di antibiotici, seppur a volte necessario, può demolire la fragile architettura della flora, preludendo a flare‑up dolorosi. Perciò, una prescrizione responsabile, preceduta da un’attenta valutazione del microbioma mediante sequenziamento metagenomico, potrebbe diventare standard di cura entro pochi anni. Il futuro, già anticipato dai primi trial di trapianto di microbiota fecale (FMT), si prospetta avventuroso: ceppi personalizzati, coltivati in vitro, attendono di essere somministrati come vaccini viventi contro l’infiammazione. Tuttavia, la sicurezza a lungo termine resta una questione irrisolta, e la comunità scientifica deve navigare con cautela tra entusiasmo e rigore metodologico. In sintesi, la danza tra artrite reumatoide e microbioma è un balletto di molecole, batteri e cellule T, i cui passi, se ben coreografati, possono guidare il paziente verso un’esistenza meno dolorosa e più armoniosa.
Lorenzo Bettinelli
ottobre 19, 2025 AT 23:12Il legame tra intestino e articolazioni mi suona come una potente metafora della vita: tutto è interconnesso. Se curiamo il nostro microbioma con attenzione, diamo al corpo la possibilità di ritrovare l'equilibrio. La dieta mediterranea, ricca di fibre e grassi buoni, diventa una sorta di pratica zen per il nostro sistema immunitario. Anche un piccolo gesto, come aggiungere un vasetto di kefir al mattino, può fare la differenza. È importante non sottovalutare il ruolo delle piccole scelte quotidiane, perché l'accumulo di buone abitudini costruisce una forte difesa. Non dimentichiamo di parlare con il nostro reumatologo prima di introdurre nuovi integratori, così da integrarli al meglio nella terapia. In conclusione, la consapevolezza è il primo passo verso un futuro meno doloroso.
Continuate a sperimentare con gioia e curiosità.
Fabio Tuzii
ottobre 24, 2025 AT 08:45Ottimo riepilogo, davvero utile!
Annapaola Paparella
ottobre 28, 2025 AT 17:19Grazie per questa analisi così dettagliata! Mi ha colpito soprattutto il riferimento ai metaboliti SCFA: è sorprendente vedere quanto il butirrato possa modulare la risposta sinoviale. Personalmente ho iniziato a includere più alimenti ricchi di fibra solubile, come avena e legumi, e ho notato un leggero miglioramento della rigidità mattutina. Credo che, oltre alla dieta, la gestione dello stress giochi un ruolo fondamentale, poiché il cortisolo può influenzare la permeabilità intestinale. Continuare a monitorare il proprio diario alimentare è un ottimo strumento per identificare trigger specifici. Non vedo l'ora di vedere più studi clinici che integrino probiotici mirati nella terapia standard.
Giovanna Rinaldi
novembre 2, 2025 AT 02:52Assolutamente, la tua visione è illuminante!!!, infatti la sinergia tra nutrizione e terapia è la chiave, e non possiamo dimenticare l'importanza del supporto psicologico, che spesso viene trascurato; un approccio olistico, che includa esercizio fisico, meditazione, e una corretta idratazione, può trasformare la gestione della AR in un percorso positivo, sostenuto da una rete di professionisti, pazienti e famiglie!!!
Jamie Quadri
novembre 6, 2025 AT 12:25🤔 Che spunto interessante! Ho provato a tenere un diario delle fibre e, sorpresa, ogni volta che aumentavo l'inulina vedevo una leggera diminuzione del dolore nelle mani. 👋 Inoltre, ho iniziato a fare yoga leggero al mattino, il che sembra migliorare la motilità intestinale. 🌱 Consiglio vivamente di sperimentare con piccolo step, così da non sovraccaricare il sistema.
Andrea Galanti
novembre 10, 2025 AT 21:59Non tutti questi interventi dietetici hanno realmente un impatto clinico significativo; spesso le evidenze sono basate su studi di piccola scala e risultati non replicabili. Inoltre, puntare su probiotici costosi può distogliere l'attenzione da terapie farmacologiche consolidate, che rimangono la pietra angolare del trattamento dell'artrite reumatoide.
Marzi Roberie
novembre 15, 2025 AT 07:32È vero che la letteratura su probiotici è ancora in evoluzione, ma non dobbiamo sottovalutare i dati emergenti che mostrano una riduzione media di 1,2 punti nel DAS28 in studi controllati. Inoltre, l'uso di prebiotici come l'inulina è supportato da trial robusti che evidenziano miglioramenti nella composizione del microbioma e, di conseguenza, nella risposta infiammatoria. Consiglio di valutare ogni caso individualmente, integrando probiotici come coadiuvante, ma senza sostituire le terapie standard.
stefani hanjaya
novembre 19, 2025 AT 17:05È d’uopo ricordare, con la massima solennità, che l’indulgenza nell’uso indiscriminato di antibiotici rappresenta una violazione etica nei confronti della salute pubblica. La responsabilità di prescrivere tali farmaci deve gravare unicamente su professionisti consapevoli, i quali dovrebbero avvalersi di test microbiologici accurati prima di ogni somministrazione. In assenza di tale diligenza, si rischia di compromettere irreparabilmente l’equilibrio del microbiota intestinale, aggravando condizioni già di per sé gravose come l’artrite reumatoide. Pertanto, esorto la comunità medica a riconsiderare le linee guida attuali e a promuovere un approccio più cauto e informato.
Giorgia Panizzo
novembre 24, 2025 AT 02:39Concordo pienamente sulla necessità di prudenza; limitare gli antibiotici è fondamentale per preservare il microbioma e migliorare gli esiti clinici.